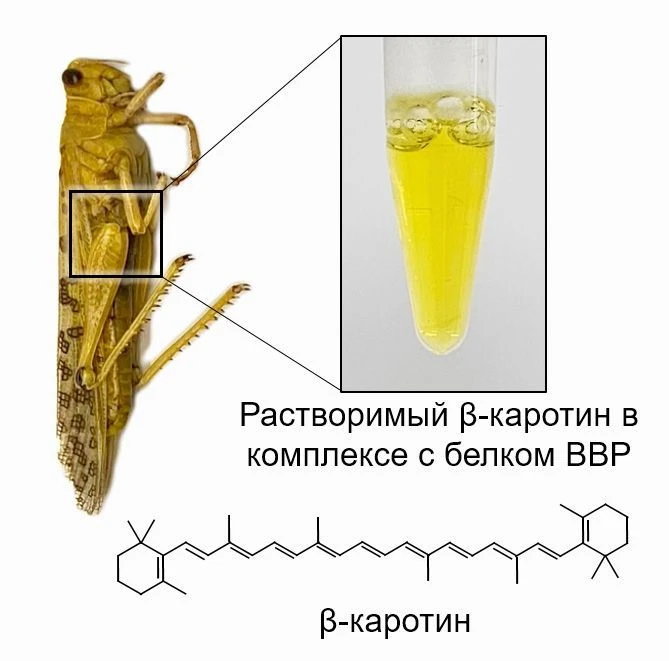
Исследователи из ФИЦ Биотехнологии РАН выяснили, что в период массовых миграций самцы саранчи «желтеют» благодаря β-каротин-связывающему белку, который связывается с хитином — полимером в покровах — и придает им окраску. Такое связывание временно, поэтому, когда заканчивается миграция, насекомые приобретают обычный сероватый оттенок. Полученные данные позволяют лучше понять механизмы адаптации насекомых к изменениям условий среды и причины перемен в их внешнем виде на разных этапах жизненного цикла. Результаты исследования опубликованы в журнале Communications Biology. Научная работа проводилась в рамках федеральной научно-технической программы развития синхротронных и нейтронных исследований, которая реализуется при поддержке национального проекта «Наука и университеты».
Пигменты каротиноиды обеспечивают окраску у самых разных живых организмов: водорослей, высших растений, ракообразных, насекомых и других. При этом часто такие пигменты образуют комплексы с белками, называемые каротинопротеинами. Например, в покровах (кутикуле) самцов саранчи есть β-каротин-связывающий белок (ВВР), который приводит к тому, что насекомые в период массовых миграций приобретают ярко-желтую окраску. Интересно, что желтая окраска у саранчи может быстро развиваться при высокой плотности популяции и также быстро исчезать, если плотность популяции снижается. Такие изменения достаточно необычны для насекомых, поскольку взрослые особи не линяют, и, значит, меняется не просто весь покров, а пигментный состав одного и того же покрова насекомого.
Ученые ФИЦ Биотехнологии РАН исследовали свойства и функции β-каротин-связывающего белка саранчи и выяснили молекулярные механизмы, лежащие в основе быстрого изменения окраски, вызванного этим белком.
В первую очередь, чтобы доказать, что от наличия ВВР зависит окраска насекомых, авторы с помощью минимальной химической обработки выделили его из покровов насекомых. Полученная в результате жидкость — экстракт — оказалась желтой, тогда как кутикула насекомых обесцветилась. Это подтвердило роль белка в окраске саранчи.
Затем, чтобы детально изучить свойства β-каротин-связывающего белка, ученые искусственно наработали его рекомбинантную форму в клетках бактерий. Сравнение с нативным белком, выделенным из кутикулы насекомых, доказало идентичность двух форм пигмента. Эксперименты показали, что ВВР состоит из двух субъединиц, то есть имеет форму димера. Кроме того, эта молекула оказалась удивительно устойчивой к воздействию кислот, щелочей, детергентов и температуры. Так, даже после 30 минут пребывания в щелочи белок сохранил свои исходные свойства, а при нагревании разрушение комплекса происходило лишь при достижении 70°С.
Авторы предположили, что стабилизировать структуру белковой молекулы помогает связываемый ею β-каротин. На это указывает то, что исследователям не удалось даже в малых количествах обнаружить молекулы белка, не связанные с β-каротином. Более того, эксперименты показали, что ВВР предпочтительно связывал β-каротин даже в ситуациях, когда количество этой молекулы было десятки раз меньше, чем других каротиноидов (кантаксантина, зеаксантина, эхиненона).
Однако наиболее интересной особенностью BBP оказалось то, что он способен связываться с хитином — основным компонентом кутикулы членистоногих. Так, в экспериментах после нанесения β-каротин-связывающего белка на хитин, этот полимер принимал желтую окраску, однако, обратимо, поскольку она вымывалась при химической обработке. Это может объяснять механизм формирования окраски у саранчи: BBP выводится из клеток эпителия насекомого в пространство под кутикулой, после чего «оседает» на хитине кутикулы, закрепляя таким образом окраску. Обратимость связывания с хитином, вероятно, обеспечивает исчезновение желтой окраски саранчи при изменении условий.
«Белок BBP уникален своей специфичностью к β-каротину, так как все ранее изученные каротиноид-связывающие белки преимущественно связывают ксантофиллы — каротиноиды, имеющие в своем составе кислород. Именно атомы кислорода в составе ксантофиллов способны образовывать водородные связи, необходимые для удержания каротиноидов ранее изученными белками. β-каротин такие связи образовывать не способен, что отличает механизм его связывания от ранее изученных. Более того, β-каротин интересен тем, что он служит предшественником витамина А, что дает возможность рассуждать о потенциальном применении данного белка в медицинских и косметических средствах», — рассказывает Никита Егоркин, младший научный сотрудник лаборатории белок-белковых взаимодействий ФИЦ Биотехнологии РАН.
Текст и иллюстрация: ФИЦ Биотехнологии РАН