В последние годы во многих развитых странах активно ведется борьба с использованием антибиотиков при выращивании животных и птицы. В России также принят ряд законодательных актов, регулирующих применение антибиотиков в сельском хозяйстве.
Все больше отечественных животноводческих и птицеводческих предприятий стремятся получить разрешение на маркировку продукции знаком соответствия «Без антибиотиков», поскольку такая продукция пользуется повышенным спросом у потребителей и при эффективном маркетинге приносит дополнительную прибыль. Однако специалисты отмечают, что в некоторых случаях полностью отказаться от антибиотиков при промышленном содержании животных и птиц крайне сложно. Когда бактериальная инфекция стремительно захватывает поголовье, антибиотики могут быть единственной линией защиты.
Антагонисты или синергисты?
Антибиотики ликвидируют возбудителей бактериальных инфекций животных и птиц, но они же часто вызывают и ряд сопутствующих патологий. Прежде всего, это непосредственное токсическое воздействие антибактериального препарата на полезных представителей нормофлоры. Учитывая, какие важные функции в организме выполняет нормофлора, игнорирование баланса микроорганизмов в кишечнике в процессе использования антибиотиков может привести к целому ряду негативных последствий: воспаление и повреждение слизистой кишечника, потеря способности энтероцитов (клеток эпителия) кишечника всасывать питательные вещества и воду, появление диареи, долгосрочное нарушение процессов пищеварения, иммунитета и пр.
Не вызывает сомнений, что даже после относительно кратковременного использования антибиотиков значительная часть поголовья нуждается в восстановлении нормобиоты кишечника, поддержке пищеварения и иммунитета. Дальнейшая антимикробная терапия не может решить эти задачи. В то же время, научно-обоснованное применение правильно подобранных пробиотиков может способствовать скорейшему завершению патологических процессов в организме животных и птиц.
Если пробиотик вводить в рацион во время антибиотикотерапии (желательно также до и после курса), негативных последствий удастся избежать. По мнению исследователей (Montassier et al., 2021), снижение численности популяций некоторых представителей микробиома антибиотиками способствует более эффективной колонизации пищеварительной системы пробиотиками. В таких условиях пробиотики оказывают еще более выраженное позитивное влияние на микробиом, стимулируя развитие нормофлоры. Кроме того, выровненный состав микробиома будет оказывать детоксикационное воздействие, что поможет «разгрузить» работу печени и почек.
Какие пробиотики можно давать с антибиотиками?
Становится очевидным, что пробиотики и антибиотики работают в партнерстве. Однако антибиотики не способны отличить полезные пробиотические бактерии от тех, которые вызывают заболевание. При этом большинство пробиотиков чувствительны к некоторым широко применяемым в практике птицеводства кормовым и ветеринарным антибиотикам. Это существенный недостаток бактериальных препаратов, который заметно ограничивает их использование, ведь их применение наряду с антибиотикотерапией неизбежно сопровождается инактивацией штаммов таких пробиотиков. Поэтому для достижения необходимой области колонизации в пищеварительной системе, пробиотические микроорганизмы должны быть устойчивыми к действию антибиотиков.
Исходя из этого, в качестве пробиотиков рекомендуется использовать полиантибиотикорезистентные штаммы микроорганизмов, которые могут применяться одновременно с антибиотиками. Для решения вопроса о возможности одновременного применения пробиотиков и антибиотиков необходимо располагать сведениями о чувствительности к ним штаммов в составе биопрепаратов.
В геноме некоторых штаммов бацилл, особенно вида Bacillus subtilis, имеется консервативная (наследуемая и сохраняемая у вида в процессе эволюции) система генов защиты от стресса оболочки клетки LiaF-LiaRS. Она обеспечивает адаптацию и устойчивость к подмножеству антибиотиков (бацитрацин, рамопланин, ванкомицин, эндурацидин), повреждающе действующих на клеточную стенку бактерий. Эта группа антибиотиков уничтожает некоторые патогенные бактерии на этапе бактериальной пролиферации (увеличения количества клеток), препятствуя образованию клеточной стенки и блокируя действия ферментов MURG, отвечающих за синтез пептидогликанов (строительных компонентов) мембраны.
Показано (Rukmana et al., 2009), что экспериментальная делеция (искусственное уничтожение, «выключение») генов LiaR и LiaS у мутантных штаммов приводит к возникновению гиперчувствительности к эндурацидину и другим антибиотикам, повреждающе действующим на клеточную стенку.
Примечательно, что данные гены отсутствуют у некоторых патогенных бактерий, в том числе, рода Clostridium, что объясняет их высокую чувствительность к некоторым антибиотикам, например, эндурацидину (Jordan et al., 2006). Именно поэтому антибиотики действует на патогенов, но не на пробиотических бацилл.
Механизм устойчивости
Многочисленные исследования доказали, что пробиотический, в т.ч., антибиотикорезистентый потенциал различных штаммов бацилл одного вида может достаточно сильно варьироваться и является штаммоспецифичной характеристикой.
Пробиотиком, который обладает устойчивостью ко многим кормовым и ветеринарным антибиотикам, является Целлобактерин-Т на основе штамма Bacillus subtilis, что было доказано при проведении полногеномного секвенирования с использованием прибора MiSeq («Illumina, Inc.», США). Для оценки пула (всей совокупности) генов, связанных с устойчивостью к антибиотикам, использовали базу данных KEGG Pathway (http://www.genome.jp/kegg/).
По результатам анализа генома штамма B. subtilis были обнаружены подсистемы (группы метаболических путей), обеспечивающие устойчивость к бацитрацину, эндурацидину и другим антибиотикам. Так, был выявлен оперон (участок хромосомы, включающий группу генов) LiaRS TCS, а именно гены, LiaR, LiaS, LiaG, LiaH, LiaI, которые отвечают за устойчивость к антибиотикам, повреждающим клеточные стенки (табл. 1, рис. 1).
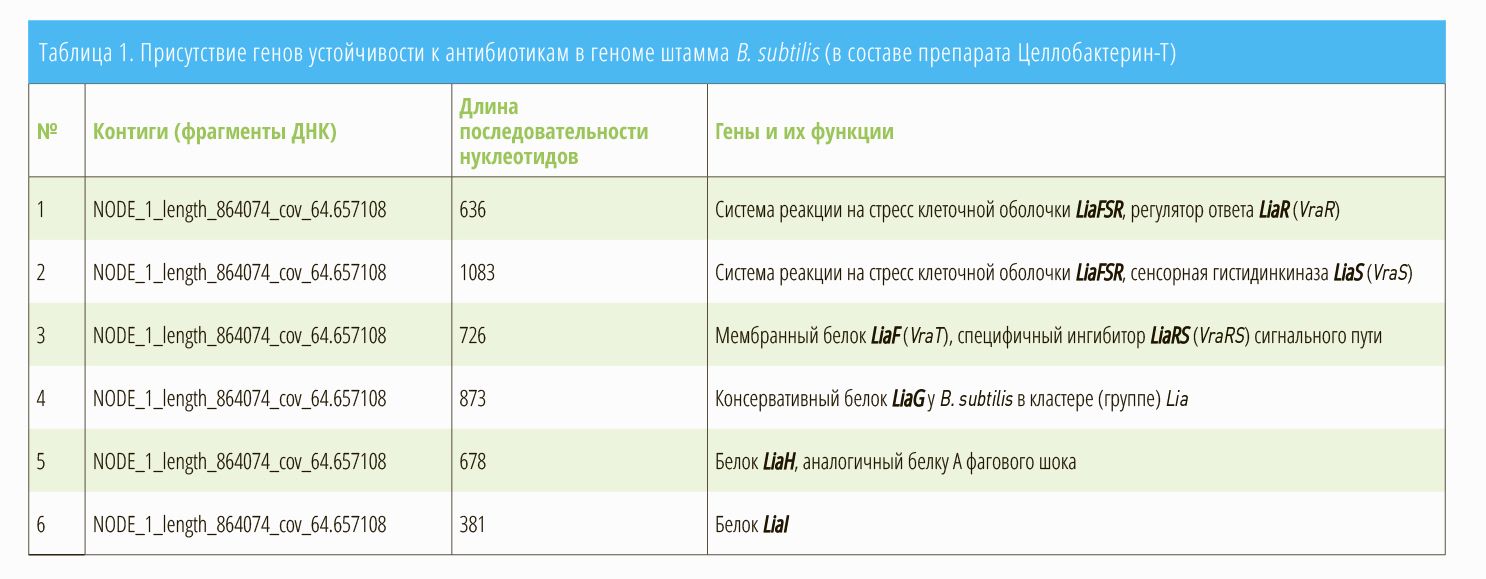
Таким образом, штамм B. subtilis в составе пробиотика Целлобактерин-Т имеет множественную устойчивость к антибиотикам, обусловленную целым комплексом генов. С одной стороны, бактерии изменяют свою внешнюю структуру таким образом, чтобы антибиотик не мог прикрепиться к ним. С другой стороны, они «перемещают» антибиотик обратно за пределы бактериальной клетки с помощью эффлюкс-насоса (т.е. выводящей помпы), прежде чем он сможет причинить бактерии вред.
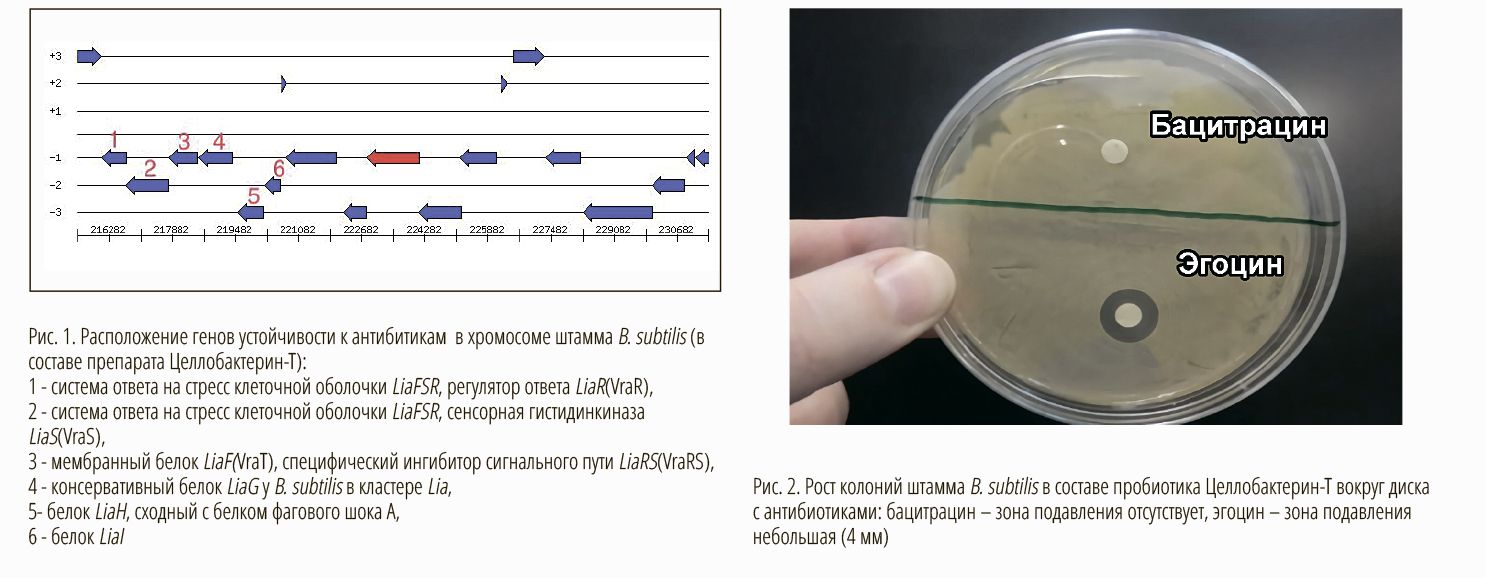
Дополнительный анализ чувствительности к антибиотикам B. subtilis в составе пробиотика Целлобактерин-Т диско-диффузионным методом подтвердил, что данный штамм сохраняет полную устойчивость как минимум к 3 антибиотикам: бацитрацин (Бацилихин), колистин (Коли-фуд) и авиламицин (Максус), а также умерен ную резистентентность к антибиотику окситетрациклин (Эгоцин).
Нечувствительность штамма B. subtilis в составе пробиотика Целлобактерин-Т к ряду антибиотиков способствует выживанию этих бактерий в условиях введения в рацион антибактериальных препаратов. Антибиотики бацитрацин, эндурацидин, колистин, авиламицин и ряд других, а также пробиотик Целлобактерин-Т не проявляют взаимный антагонизм и являются абсолютно совместимыми и взаимодополняющими группами препаратов.
Этот факт, в частности, объясняет высокий уровень пробиотической активности данного биопрепарата на фоне применения антибиотиков. Результаты многочисленных производственных испытаний показали, что при совместном применении пробиотика Целлобактерин-Т и антибиотиков увеличение среднесуточного привеса бройлеров составляло от 3 до 10%, возможность увеличения ввода подсолнечного шрота в ростовые и финишные рационы при этом составляла до 20-30% без снижения зоотехнических показателей, наблюдалось увеличение сохранности птицы, индекса продуктивности, яйценоскости, улучшение конверсии корма.
Есть ли риск распространения резистентности?
Известно, что бактерии могут обмениваться генетической информацией. Микроорганизмы, используемые в составе пробиотических добавок, резистентные к антибиотикам, в некоторых случаях могут становиться источником приобретенных детерминант (факторов/ генетических единиц) устойчивости к антибиотикам для бактерий, обитающих в пищеварительной системе животных и птиц, тем самым внося свой вклад в распространение антибиотикорезистентности.
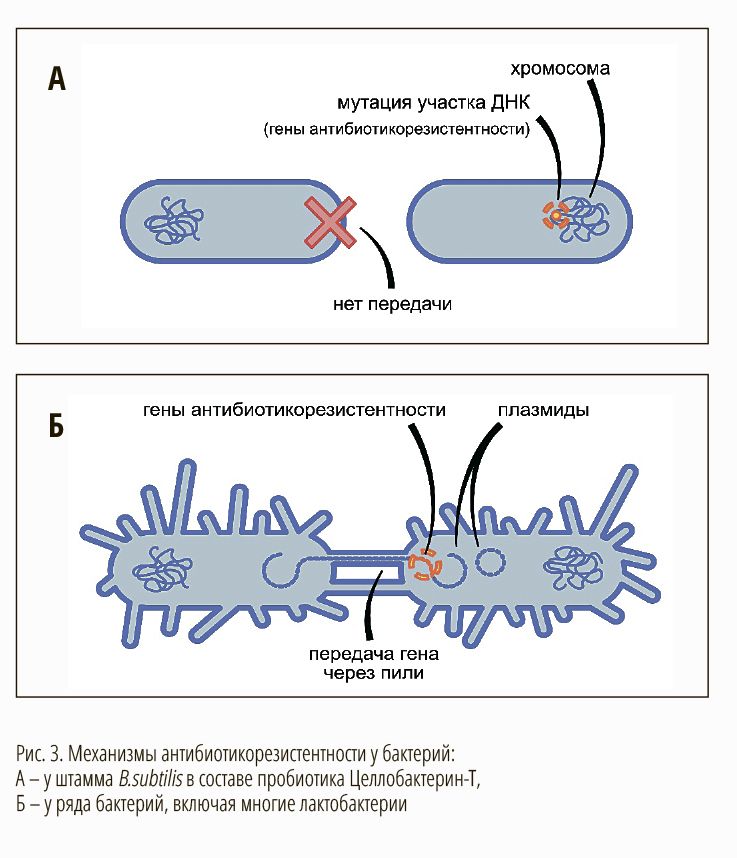
Дело в том, что генетической основой антибиотикорезистентности у бактерий являются:
1. мутации в собственной хромосомной ДНК;
2. внедрение чужеродной ДНК путем горизонтального переноса генетического материала — обмена подвижных генетических элементов (плазмид или транспозонов) между бактериями.
Во втором случае может происходить передача генов антибиотикорезистентности между бактериями (рис. 3).
У лактобактерий, выделенных из некоторых пищевых продуктов и пробиотиков, обнаружены приобретенные гены устойчивости, способные к горизонтальному переносу in vitro и in vivo (Анисимова, Яруллина, 2020). Экспериментально доказана передача гена устойчивости к тетрациклину tetM от лактобактерий к Enterococcus faecalis и Lactoccocus lactis. Наиболее распространенным механизмом передачи генов антибиотикорезистентности у лактобактерий является конъюгация. Эти находки настораживают и требуют контроля за культурами молочнокислых бактерий, используемых для производства пробиотиков, в плане отсутствия мобильных генетических элементов, которые включают гены антибиотикорезистентности.
Генетическое отличие штамма Bacillus subtilis в составе пробиотика Целлобактерин-Т от некоторых других групп бактерий заключается в том, что устойчивость к антибиотикам у него «природная» или «внутренняя», т.е. приобретенная в ходе эволюции в результате хромосомных мутаций, предполагающих перестройку целых фрагментов ДНК. Более того, эта устойчивость комплексная: она кодируется целой системой генов (набором из минимум 6-ти генов). Важно, что в мобильных фрагментах генома Bacillus subtilis в составе пробиотика Целлобактерин-Т гены резистентности не присутствуют. Такая хромосомно-опосредованная резистентность означает, что гены антибиотикорезистентности не передаются другим бактериям (Сухорукова и др., 2012).
Более того, при проведении экспериментов на бройлерах с использованием метода количественной ПЦР с обратной транскрипцией мы показали, что применение пробиотика на основе Bacillus sp. приводит к снижению экспрессии (работы) генов антибиотикорезистентности (таких, как bla_shv, ampC и mrcA) от 1,3 до 6,1 раза у кишечного микробиоценоза. Это связано с восстановлением состава нормобиоты и снижением доли патогенов, склонных к интенсивному обмену генетической информацией.
Работа в партнерстве
Таким образом, антибиотики и пробиотики не должны рассматриваться как несовместимые группы препаратов. Их совместное рациональное использование в рамках соблюдения законодательства об использовании антибиотиков создает предпосылки для достижения максимального результата в широком спектре неблагоприятных ситуаций. Тем не менее, устойчивость к антибиотикам у пробиотиков считается одним из важных свойств в случаях применения на поголовье комбинаций этих препаратов. Однако многие пробиотики чувствительны к некоторым широко применяемым в практике птицеводства кормовым и ветеринарным антибиотикам, поэтому их использование совместно с антибиотиками иногда становится не эффективным.
Сегодня, без сомнения, качественным пробиотиком с доказанной эффективностью и естественной полиантибиотикорезистентностью является Целлобактерин-Т на основе B. subtilis. Полученные данные свидетельствуют об отсутствии вероятности передачи детерминант устойчивости от штамма в составе данного пробиотика другим видам бактерий, обитающих в кишечнике ввиду их хромосомного расположения.













